 Epigenetic regulation during cancer transitions across 11 tumour types
Epigenetic regulation during cancer transitions across 11 tumour types
题目: 癌症转变过程中的11种肿瘤类型的表观遗传调控
DOI: https://doi.org/10.1038/s41586-023-06682-5 (opens new window)
Cite: Terekhanova, N.V., Karpova, A., Liang, WW. et al. Epigenetic regulation during cancer transitions across 11 tumour types. Nature 623, 432–441 (2023).
作者介绍:
| Li Ding |
|---|
 |
| Department of Medicine, Washington University in St Louis, St Louis, MO, USA |
| lding@wustl.edu |
# Abstract:
染色质可及性在调控基因表达和细胞身份方面至关重要,并且可及性的改变已被认为涉及驱动癌症的启动、进展和转移。尽管已经研究了致癌转变的遗传贡献,但对表观遗传驱动因子的理解仍较少。在这项研究中,我们利用来自225个样本的单核染色质可及性数据以及来自206个样本的匹配的单细胞或单核RNA测序表达数据,构建了一个全癌症的表观遗传和转录组图谱。通过对每个平台上的超过100万个细胞进行可及染色质区域、转录因子 motif 和调控子的富集分析,我们鉴定了与癌症转变相关的表观遗传驱动因子。一些表观遗传驱动因子出现在多种癌症中(例如,ABCC1和VEGFA的调控区域;GATA6和FOX家族 motif ),而其他一些是癌症特异性的(例如,FGF19、ASAP2和EN1的调控区域,以及PBX3 motif )。在表观遗传改变的通路中,TP53、缺氧和TNF信号与癌症启动有关,而雌激素应答、上皮-间质转化和上皮细胞连接与癌症转移有关。此外,我们揭示了增强子可及性与基因表达之间的显著相关性,并揭示了表观遗传和遗传驱动因子之间的合作关系。该图谱为进一步研究癌症转变中的表观遗传动态奠定了基础。
# Main:
表观遗传调控影响基因表达、细胞谱系决定、细胞间相互作用和治疗抵抗。在这里,我们将表观遗传驱动因子定义为与癌症启动、进展和转移相关的调控元件或转录因子(TFs)的活动,通常是通过与遗传驱动因子的相互作用实现的。这样的表观遗传驱动因子可能解释先前未知的致瘤机制。
最近发展的单核ATAC-seq(snATAC-seq)提供了更高的分辨率,可以检查单个细胞的表观遗传组。将snATAC-seq与单核RNA测序(snRNA-seq)结合起来,可以同时对同一单个细胞的表观遗传组和转录组进行分析,从而直接分析染色质可及性与基因转录之间的关联。我们构建了一个综合的多组学图谱,包括来自200多名患者的11种主要癌症类型。大量的样本和癌症类型及状态的广泛代表(例如,正常、原发和转移性)为研究癌症中的表观遗传驱动因子提供了一个具有很强动力的队列。
我们提供了一个关于谱系特异性和癌症特异性细胞群体、差异可及的增强子和启动子、表观遗传调控的癌症相关基因以及在主要癌症转变中具有重要作用的转录因子的统一图谱。尽管其中一些驱动因子和转录程序与多种癌症类型的转变相关,但另一些表现出较高的癌症类型特异性。
# Results:
# Figure 1: Chromatin accessibility patterns across 11 cancer types.
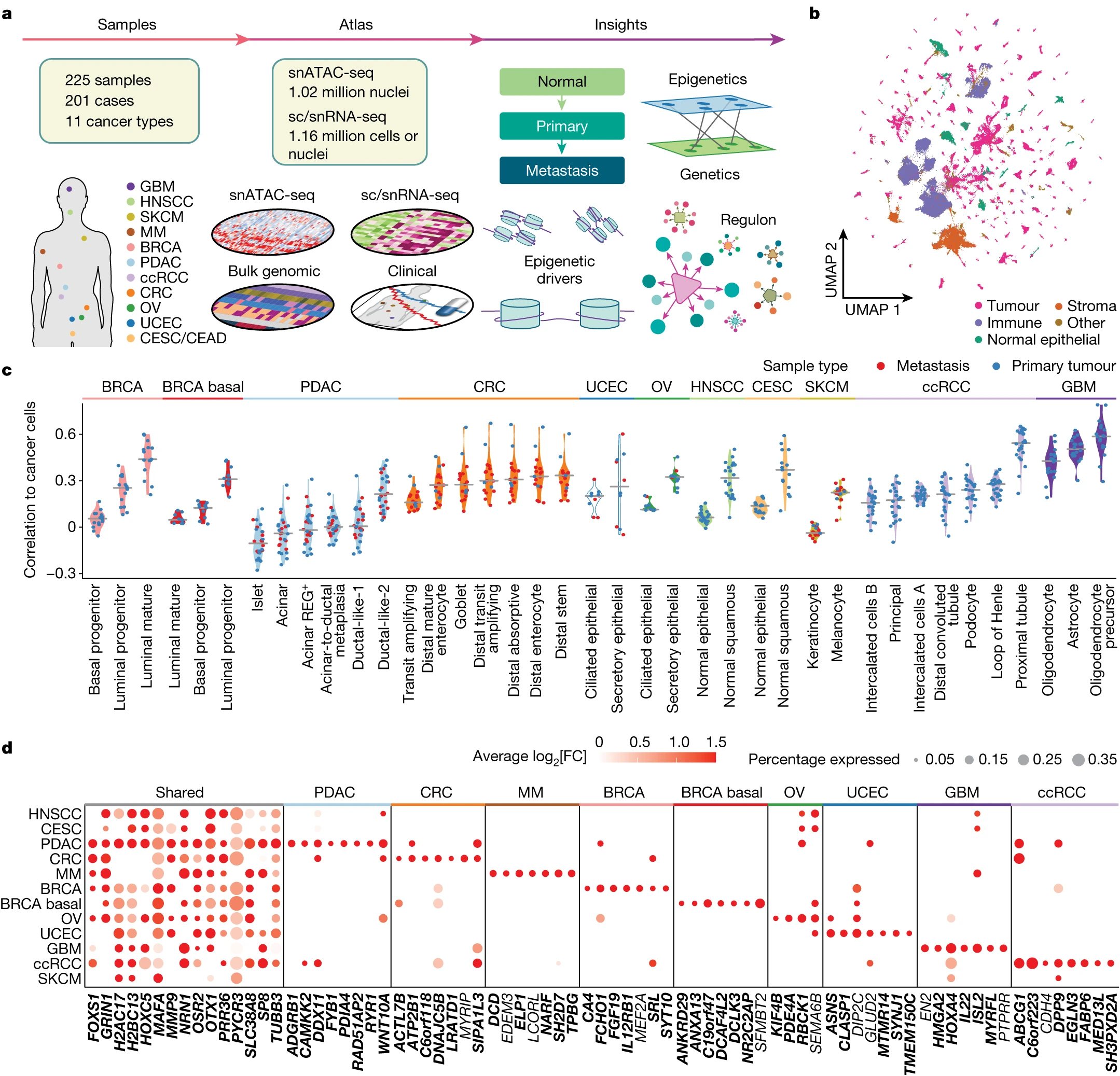
Figure 1. 11 种癌症类型的染色质可及性模式
(a) 数据生成和研究设计的示意图,展示了收集的癌症类型和样本类型、构建、注释和整合图谱的过程,以及调查的生物实体。
(b) 综合的pan-cancer snATAC-seq对象的UMAP图
(c) 每个肿瘤的癌细胞与肿瘤组织的正常细胞类型之间的Pearson相关系数。 细胞类型按中位相关系数升序排列;最右边的细胞类型被视为CNC,并随后用作识别与癌症相关的表观遗传驱动因子的参考。
(d) 通过比较癌细胞与CNCs,识别出的前癌细胞关联的DACRs。气泡大小显示具有可访问DACRs的癌细胞的百分比,颜色传达log2(FC)。x轴显示每个DACR的最近基因。基因按照在癌症之间共享的和特定于癌症类型的方式分组。癌症特异性的DACRs是基于每种癌症类型(列)中的特异性和折叠变化(FC)来选择的,或者如果它们被最大数量的癌症所共享。如果ACR在>5%的癌细胞中可访问,则显示正log2(FC)。
# Figure 2: CREs regulating transcriptional programs in cancer.
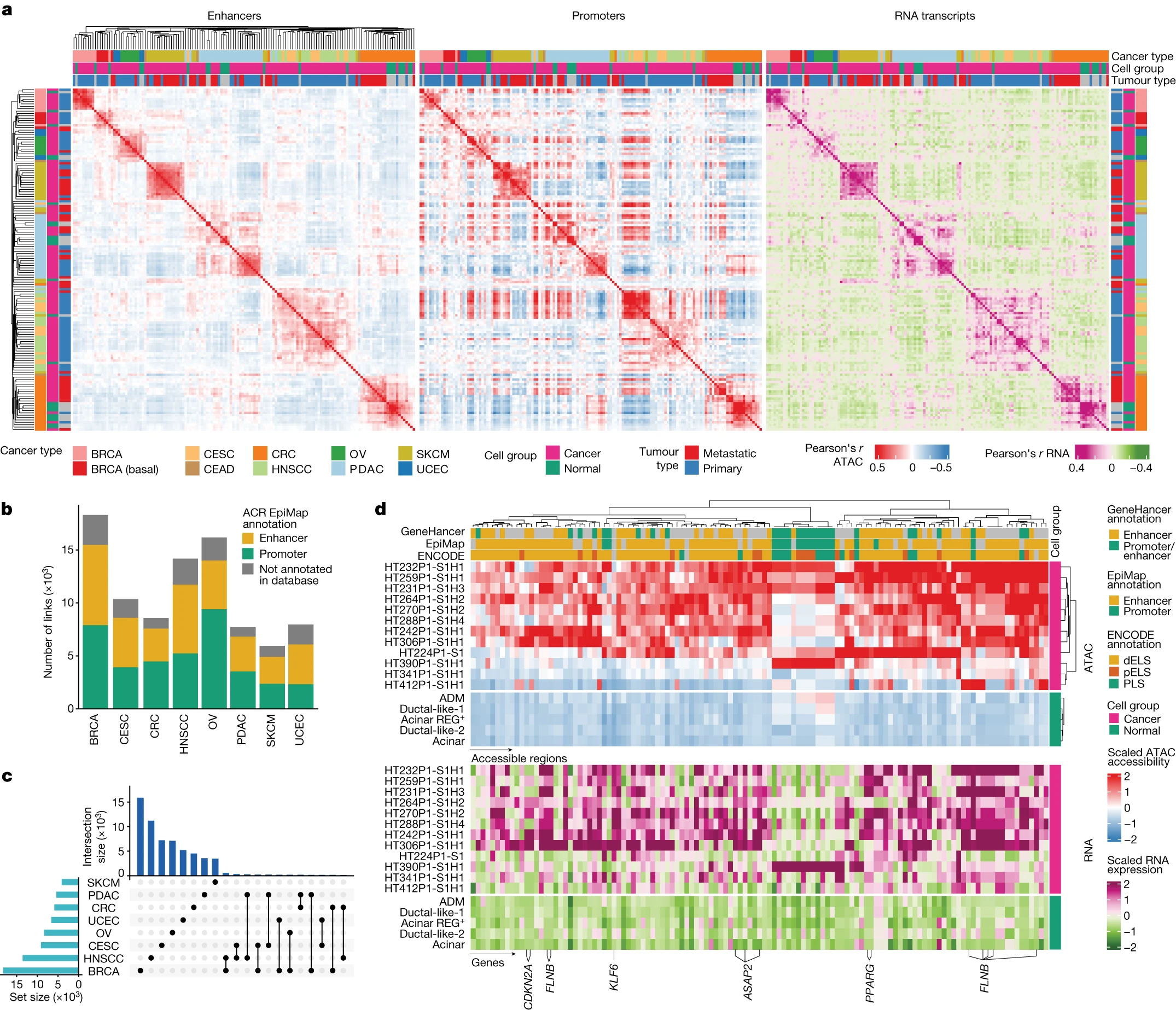
Figure 2. CRE 调节癌症转录程序
(a) 基于重叠EpiMap增强子区域(左侧)、重叠EpiMap启动子区域(中间)和RNA转录本(右侧)的ACR可访问性,计算同一组织中的癌细胞和正常细胞(snMultiome-seq样本)之间的样本级Pearson相关系数。
(b) 按癌症类型计算的ACR与基因链接的计数,并根据ACR的EpiMap注释着色。
(c) 一个UpSet图显示大多数增强子与基因的链接是癌症类型特异性的。底部右侧的连接点表示在所示的癌症类型之间共享的ACR与基因的链接。
(d) PDAC癌细胞中与基因表达相关的ACR的可访问性(上图)和基因表达(下图)。
# Figure 3: Pan-cancer and cancer-specific regulons.
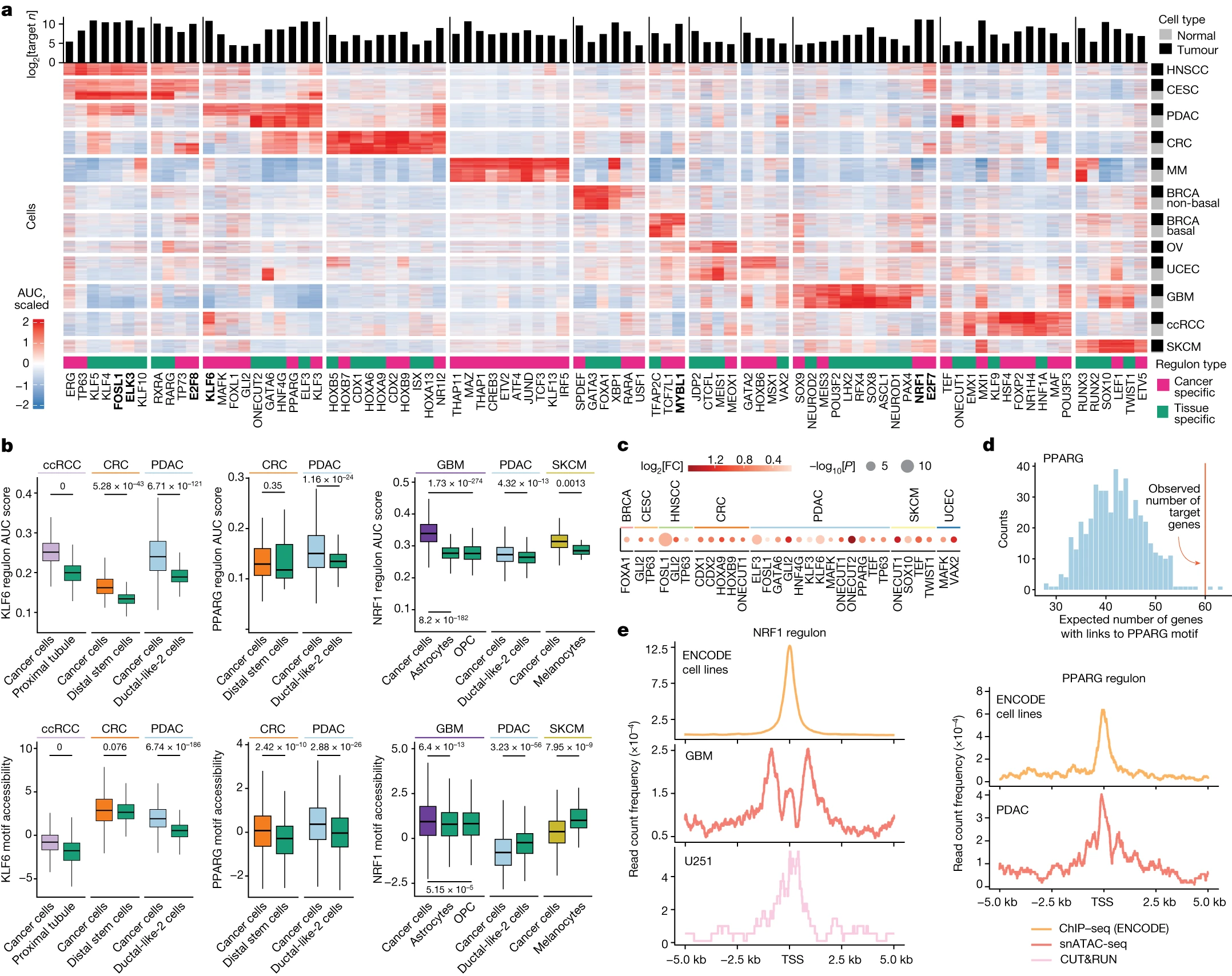
Figure 3. 泛癌和癌症特异性调节子
(a) 通过在单细胞/单核RNA测序数据上使用SCENIC技术,我们确定了组织和癌细胞特异性的调控基因网络(列)。在这里,一个调控基因网络由一个转录因子(TF)及其n个目标基因组成,顶部显示了基因数量。热图展示了从每种癌症中随机选择的200个肿瘤细胞和200个正常细胞的标准化曲线下面积(AUC)得分。与CNC相比,癌特异性的调控基因网络在癌细胞中显示出更高的活性。
(b) 显示了原发性癌细胞和相应的CNC中调控基因网络的活性得分(顶部),以及转录因子结合位点的可及性得分(底部)。
(c) 转录因子(TF)的目标基因富集了特定TF结合位点的ACR到基因的链接。颜色表示观察到的与这些链接相关的目标基因数量与随机基因数量之间的log2(FC)。
(d) 这是一个关于随机抽样基因中含有PPARG特异性PDAC ACR到基因链接数量的正态分布示例。红线表示观察到的含有PPARG特异性ACR到基因链接的PPARG目标基因数量。
(e) 目标基因的TSS周围存在ChIP-seq峰值(ENCODE)、snATAC-seq峰值或CUT&RUN峰值的存在情况。
# Figure 4: Epigenetic programs activated in cancer metastasis.
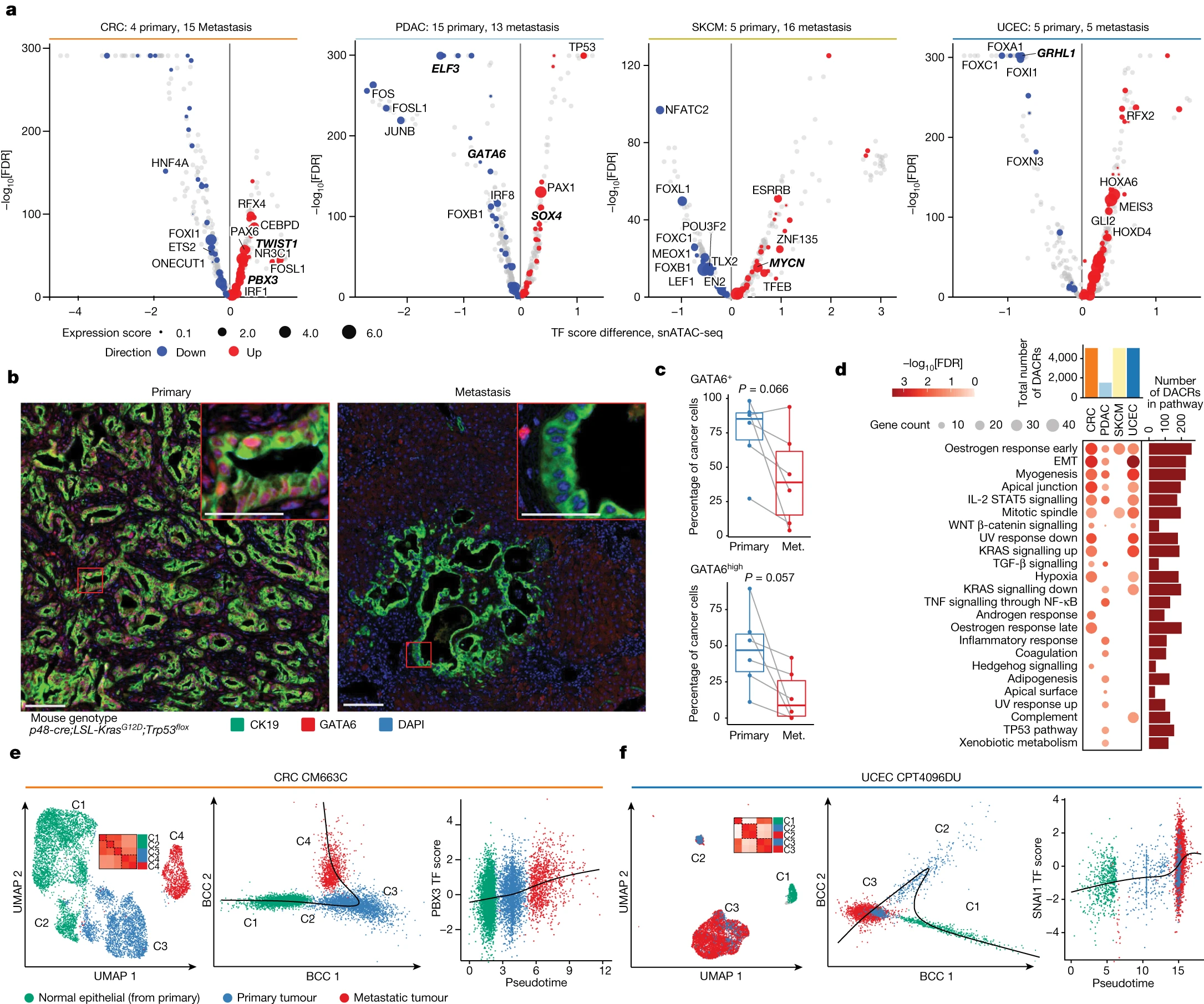
Figure 4. 癌症转移中激活的表观遗传程序
(a) 四种癌症类型的转移灶与原发灶样本之间TF结合位点可及性差异的转录因子。y轴显示使用双侧Wilcoxon秩和检验计算的经过FDR调整的P值。表达分数对应于转录因子在转移灶和原发癌细胞之间的表达的log2(FC)的值。
(b) 对PDAC小鼠模型中GATA6(红色)表达的mpIHC分析。CK19(绿色)标记癌细胞,DAPI(蓝色)标记细胞核。
(c) 与相配的转移性(met.)PDAC相比,原发PDAC中GATA6+和GATA6high 表达的癌细胞百分比较高。
(d) 转移灶与原发肿瘤中DACRs上调的显著和提示性(FDR≤20%)hallmark通路富集。
(e,f) CRC病例(e)和UCEC病例(f)的UMAP图(左)显示了配对的原发和转移样本。小热图显示基于每个样本中每个聚类的TF结合位点分数的Pearson相关系数。散点图显示沿着由Slingshot识别的轨迹排序的细胞(中心),以及显示PBX3(e)或SNAI1(f)结合位点可及性与伪时间进展之间关联的散点图(右)。
# Figure 5: The impact of genetic drivers on chromatin accessibility.
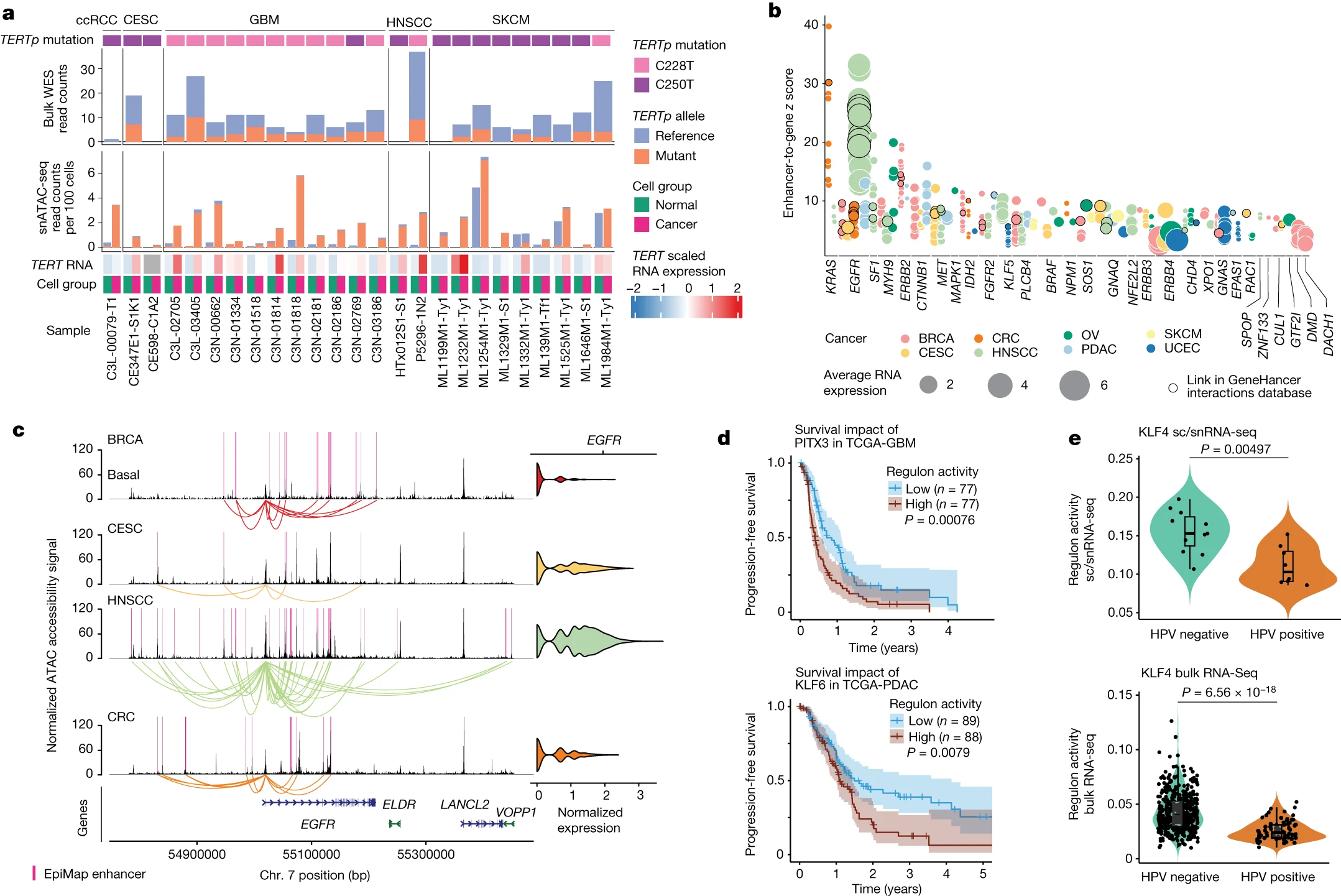
Figure 5.遗传驱动因素对染色质可及性的影响
(a) 从snATAC-seq数据和WES数据中检测到的五种癌症类型中的TERTp突变(C228T和C250T)。显示了在批量WES数据(顶部)和snATAC-seq数据(底部)中支持参考或突变等位基因的读数。对于snATAC-seq支持的读数,分别计算了癌细胞和正常细胞,然后归一化到每个组中的细胞总数。底部的热图显示了每个样本中癌症和正常细胞中的TERT表达。
(b) 使用snMultiome-seq数据鉴定的已知癌基因的表观遗传调控。每个点显示一个增强子到基因的连接z score。
(c) BRCA basal、CESC、HNSCC和CRC癌症细胞中EGFR区域的覆盖度图。仅包括EGFR CNV中性的样本。右侧显示了EGFR RNA表达。
(d) 根据PITX3 regulon活性(顶部)在TCGA-GBM队列中的进展无病生存的Kaplan-Meier图和分析,以及根据KLF6 regulon活性(底部)在TCGA-PDAC队列中的进展无病生存的 Kaplan-Meier 图。
(e) 来自这项研究的HPV阳性和HPV阴性HNSCC(顶部)以及TCGA-HNSCC(底部)样本中KLF4的regulon活性。
# Discussion:
1.我们创建并研究了一个包括11种癌症类型、225个样本的大规模单细胞多组学图谱,揭示了多样化的癌症和正常组织细胞类型。
2.原发性和转移性肿瘤之间的染色质可及性差异可能为中断转移过渡提供线索。在开放染色质中GATA6 TF motif 减少,并且与原发性PDAC相比,转移性PDAC中GATA6的表达减少。 本研究中批量WES、snRNA-seq和snATAC-seq的集成分析进一步突显了TERTp突变在癌症中的等位特异性染色质可及性效应。
3.了解跨肿瘤的染色质架构景观、癌症关键过渡中的染色质可及性变化以及染色质可及性、遗传变异和转录模式之间的相互作用对推动癌症生物学和临床实践至关重要。代表癌症发生和转移蔓延的关键事件/驱动因子的染色质可及性变化可能是潜在的治疗靶点。
