 Spatially resolved gene regulatory and disease-related vulnerability map of the adult Macaque cortex
Spatially resolved gene regulatory and disease-related vulnerability map of the adult Macaque cortex
题目: 成年猕猴皮层的空间解析基因调控和疾病相关易感性图谱
DOI: https://doi.org/10.1038/s41467-022-34413-3 (opens new window)
Cite: Lei Y, Cheng M, et al. Spatially resolved gene regulatory and disease-related vulnerability map of the adult Macaque cortex. Nat Commun. 2022 Nov 8;13(1):6747.
作者介绍:
| Xun Xu |
|---|
 |
| BGI-Hangzhou & University of Chinese Academy of Sciences |
| xuxun@genomics.cn |
# Abstract:
单细胞方法增加了我们对非人类灵长类动物(NHP)细胞类型组成的了解,但区域特异性调控特征的详细表征仍然悬而未决。我们生成了来自成年雌性食蟹猴大脑前额皮质 (PFC)、初级运动皮质 (M1) 和初级视觉皮质 (V1) 的 358,237 个细胞的单细胞转录组和染色质可及性 (单细胞 ATAC) 数据,并整合了该数据集使用相应皮质区域的 Stereo-seq(空间增强分辨率组学测序)将空间位置信息分配给分子状态。我们确定了区域特异性染色质可及位点及其靶基因,包括与兴奋性神经元异质性相关的细胞类型特异性转录调控网络。我们揭示了与 PFC 和 M1 专门功能相关的钙离子运输和轴突引导基因,确定成年猕猴和人类少突胶质细胞轨迹之间的异同,并将人类疾病的遗传变异和基因变化映射到 NHP 皮质细胞。该资源在 NHP 皮层的单细胞和空间分辨率分辨率下建立了转录组学和染色质可及性组合调控景观。
# Introduction:
将表观遗传分析与基因表达谱相结合可以产生对脑细胞分子特性的补充理解。然而,在特定区域和单细胞分辨率下对猕猴皮层基于单细胞的染色质可及性进行系统表征,这是推进该领域的一个要求,仍然悬而未决。在本研究中,我们试图了解转录和表观遗传调控状态在功能不同的皮质区域之间有何不同。通过我们的大规模并综合的分析,我们以空间分辨率的方式定义了细胞类型特异性和区域特异性的调控元素,解决了非人灵长类动物大脑不同皮质区域中神经细胞类型,特别是兴奋性神经元之间的单细胞基因表达程序。我们还将我们的数据应用于描绘髓鞘化的动态调控景观,将猕猴皮质细胞类型与人类神经疾病风险联系起来。
# Results:
# Figure 1: Single nucleus transcriptome and chromatin accessibility of macaque cortex.
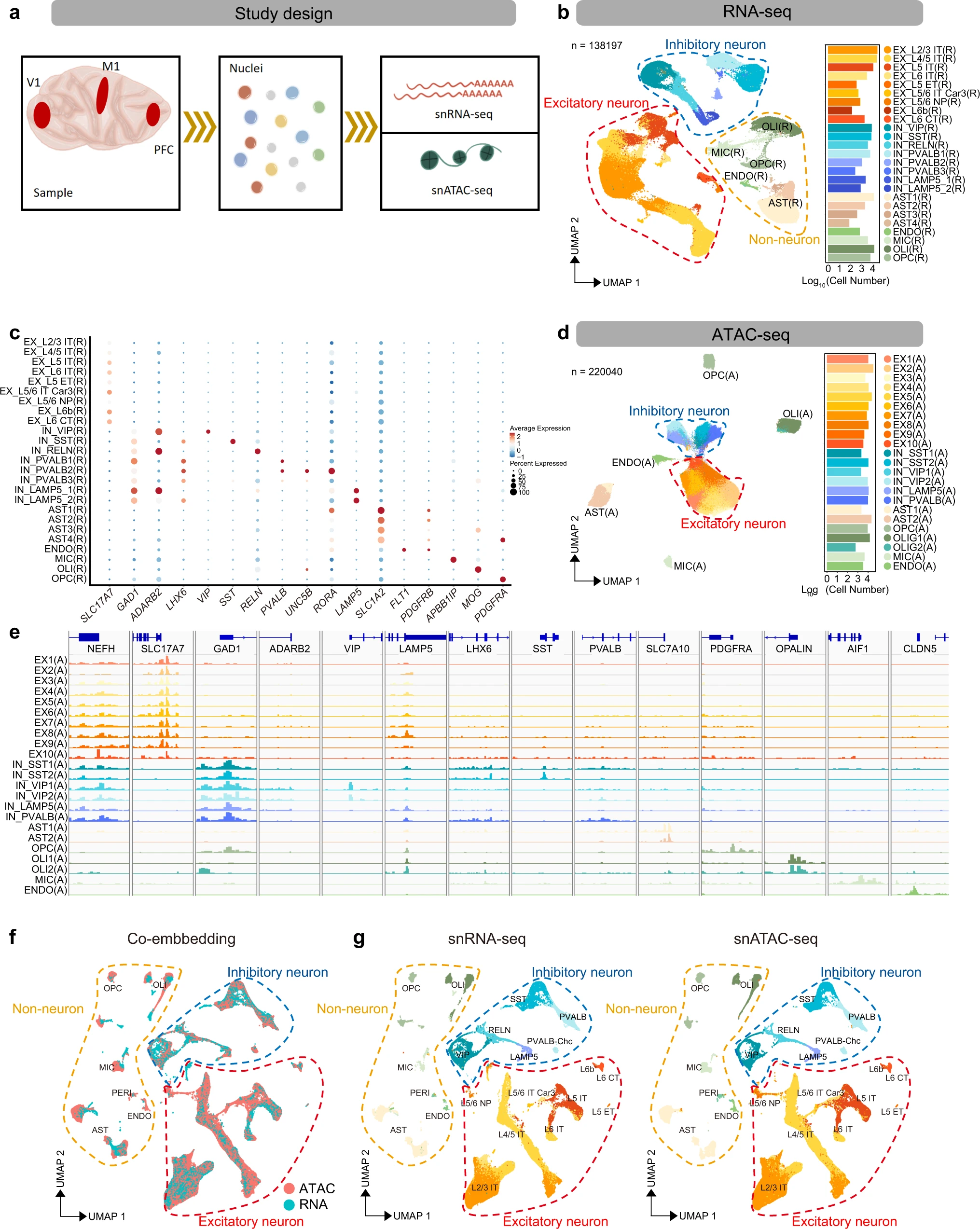
Figure 1. 猕猴皮层的单核转录组和染色质可及性
(a) 从前额叶皮层 (PFC)、初级运动皮层 (M1) 和初级视觉皮层 (V1) 中分离单核的示意图工作流程,用于 snATAC-seq 和 snRNA-seq、样品处理、文库生成和下游分析。
(b) snRNA-seq 数据的UMAP,显示按细胞类型着色的所有簇(N = 138,197 个细胞)(左),条形图显示每种细胞类型的细胞数量(右)。
(c) snRNA-seq 数据中神经元和非神经元细胞类型标记基因表达值的点图。
(d) snATAC数据的UMAP可视化,显示按细胞类型着色的所有簇(N = 220,040个细胞)(左),条形图显示每种细胞类型的细胞数(右)。
(e) 综合基因组学查看器 (IGV) 图,显示神经元和非神经元细胞类型特异性标记基因上每个细胞簇内细胞的颜色编码聚合读取密度。
(f) 使用Seurat V3 (N = 347,682 cells)在PFC, M1 and V1 大脑区域共嵌入 snRNA-seq 和 snATAC-seq 簇。
(g) 来自(f)的snRNA-seq(N = 138,197个细胞)和snATAC-seq细胞(N = 209,485个细胞)的UMAP投影。每个UMAP中的细胞簇都根据细胞身份进行颜色编码和注释。
# Figure 2: Transcriptional regulation of the cell type-specific and area-specific gene expression.
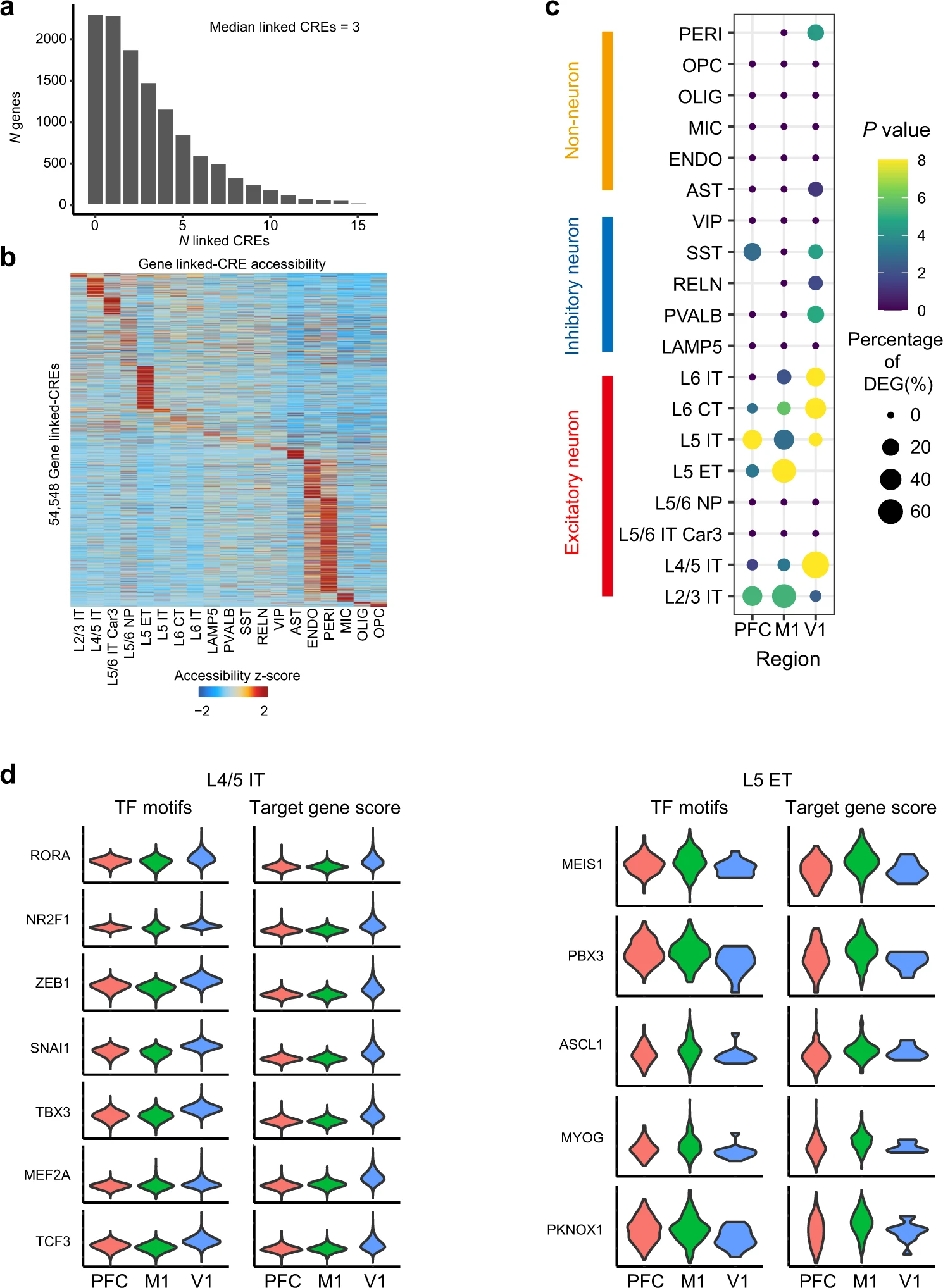
Figure 2. 细胞类型特异性和区域特异性基因表达的转录调控
(a) 直方图显示与顺式调控元件(CREs)相关的基因数量。
(b) 热图显示了每种细胞类型snATAC-seq细胞中的行标准化基因连锁CRE。
(c) 神经元和非神经元细胞类型中每个皮质区域的差异可及峰(DA峰)靶向基因与差异表达基因(DEGs)之间重叠基因的点图。
(d) 空间转录组学小鼠胚胎数据集上细胞类型映射(左)和SOView(右)之间的可视化比较。
(e) 在snATAC-seq L1/4 IT型兴奋性神经元(左)和snATAC-seq L5 ET型兴奋性神经元(右)的M1中显着上调的选定TF的基序富集和靶基因评分的小提琴图。
# Figure 3: Specialized transcriptomics of excitatory neuron between macaque prefrontal cortex and motor cortex.

Figure 3. 猕猴前额叶皮层和运动皮层之间兴奋性神经元的特异转录组学
(a) 每个兴奋性神经元亚型中 PFC 和 M1 之间差异表达基因的数量。
(b) 基因本体术语在 PFC 和 M1 的差异表达基因中丰富,小提琴图分别显示 L5 ET、L6 CT、L4/5 IT 和 L6 IT 型兴奋性神经元的 PFC 和 M1 之间选定的 DEG 的表达。使用未配对的两个样本单侧Wilcoxon检验进行区域间基因表达比较并进行Bonferroni校正。
# Figure 4: Characterization of cortical gene expression by Stereo-seq.
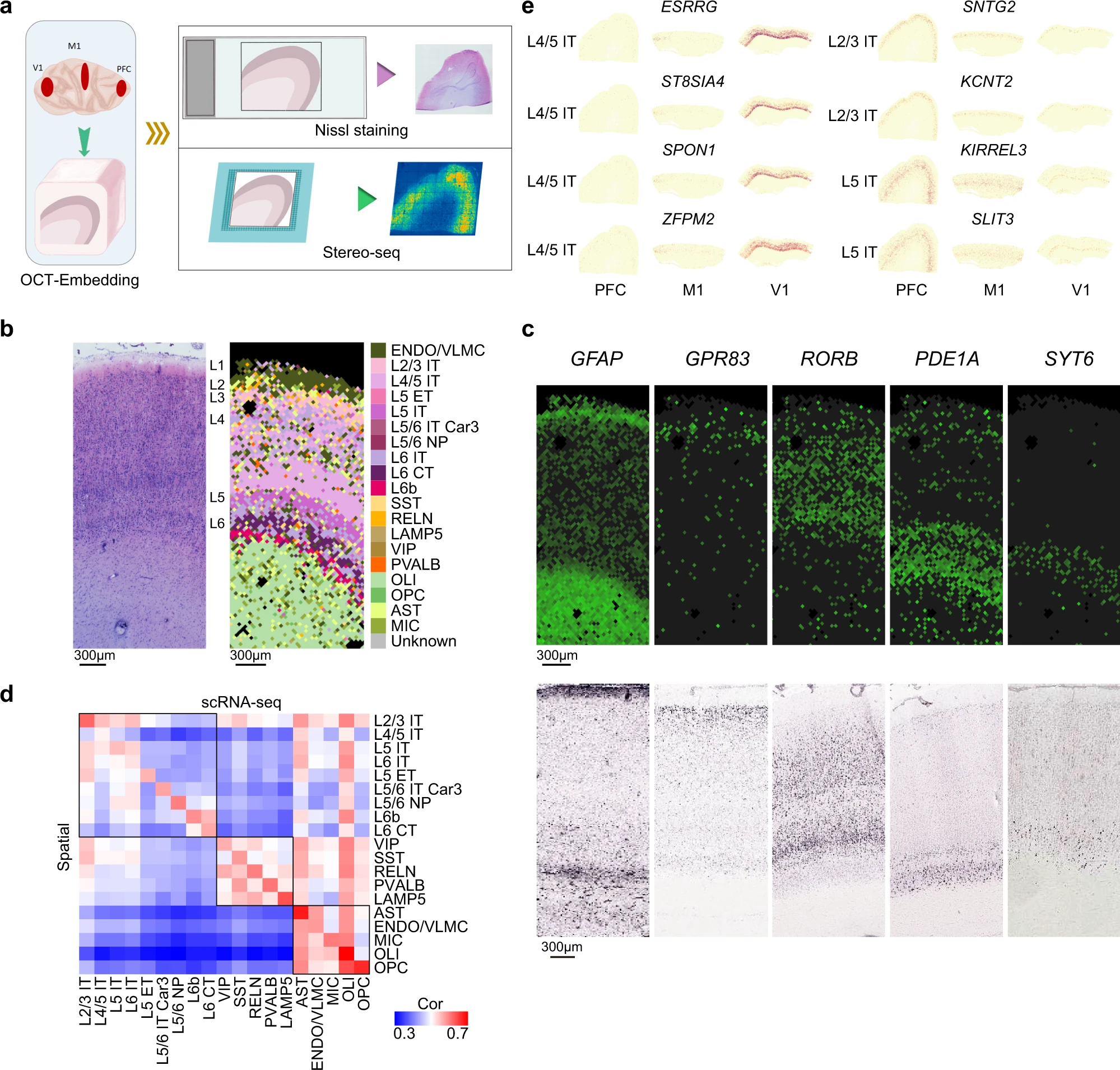
Figure 4. 通过 Stereo-seq 表征皮质基因表达
(a) 前额叶皮层 (PFC)、初级运动皮层 (M1) 和初级视觉皮层 (V1) 的组织采样和立体测序的示意性工作流程。
(b) 初级视觉皮层立体序列切片的相邻切片的尼氏染色(左),以及通过 snRNA-seq 数据对初级视觉皮层立体序列切片的 37.5 μm bin 进行的细胞类型注释(右)。
(c) stereo-seq中已知层标记基因表达的代表性显微照片,实验在 2 个切片中独立进行,以及来自猕猴大脑初级视觉皮层中相应层标记的 RNA ISH 图像。
(d) 热图显示 Stereo-seq 与 snRNA-seq 数据中识别的簇之间的 Spearman 等级相关性。
# Figure 5: Integrated single cell regulatory landscape of oligodendrocyte trajectory.
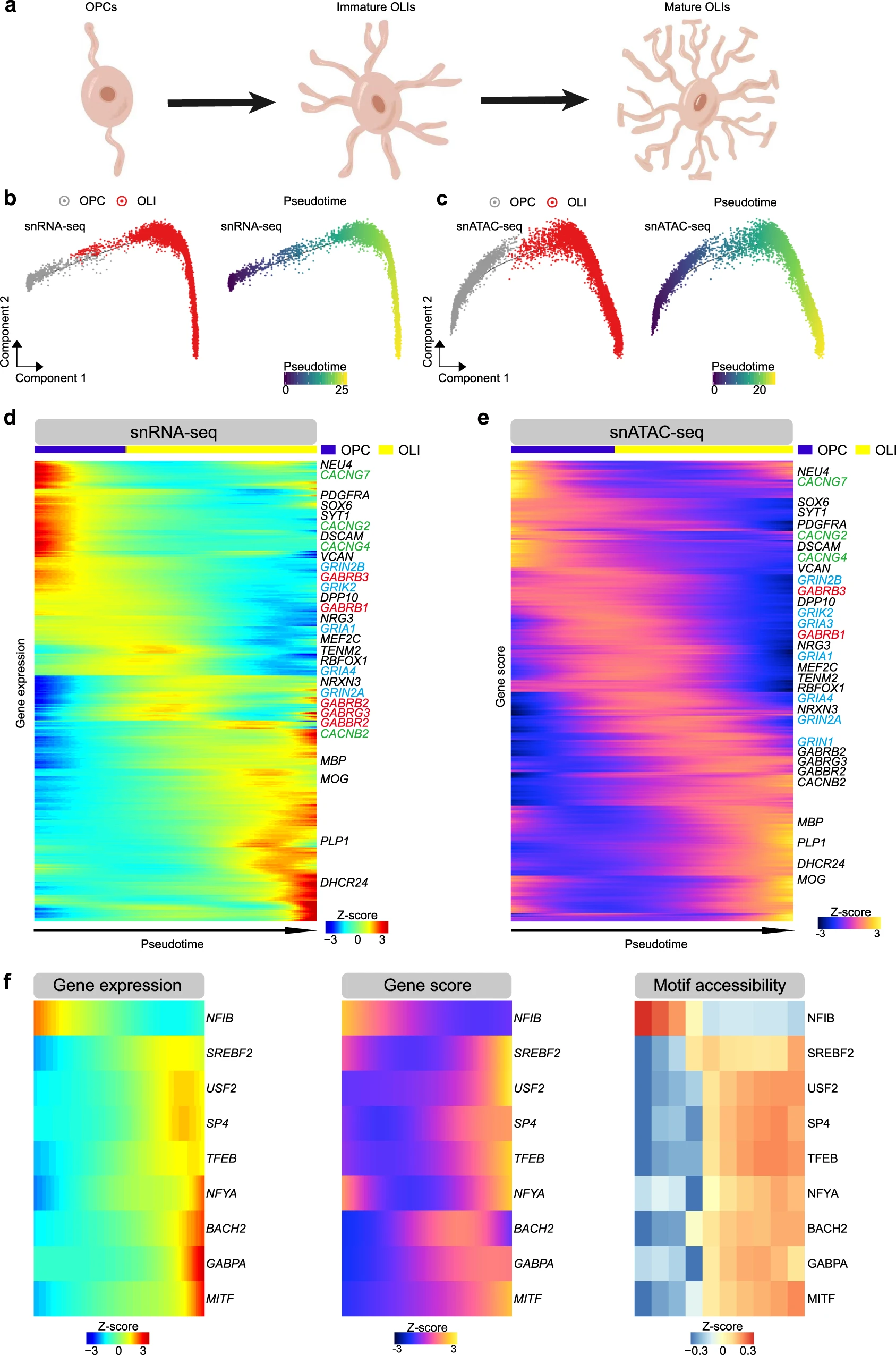
Figure 5. 少突胶质细胞轨迹的综合单细胞调控景观
(a) 少突胶质细胞成熟的示意图。
(b) OPC 和 OLI 的伪时间轨迹,指示从 snRNA-seq 数据获得的基因表达。
(c) OPC 和 OLI 的伪时间轨迹指示从 snATAC-seq 数据获得的基因活性评分。
(d) 热图显示 ( b ) 中所示少突胶质细胞谱系伪时间轨迹的基因表达动态。谷氨酸受体、γ-氨基丁酸(GABA)受体和钙通道(VGCC)的基因分别用蓝色、红色和绿色编码。
(e) 热图显示 ( c ) 中少突胶质细胞谱系伪时间轨迹的可及性动态(基因活性评分
(f) OLI 伪时间轨迹上 9 个 TF 的基因表达(左)、基因活性评分(中)和基序富集(右)
# Figure 6: Cell type enrichment of heritability and dysregulated genes.
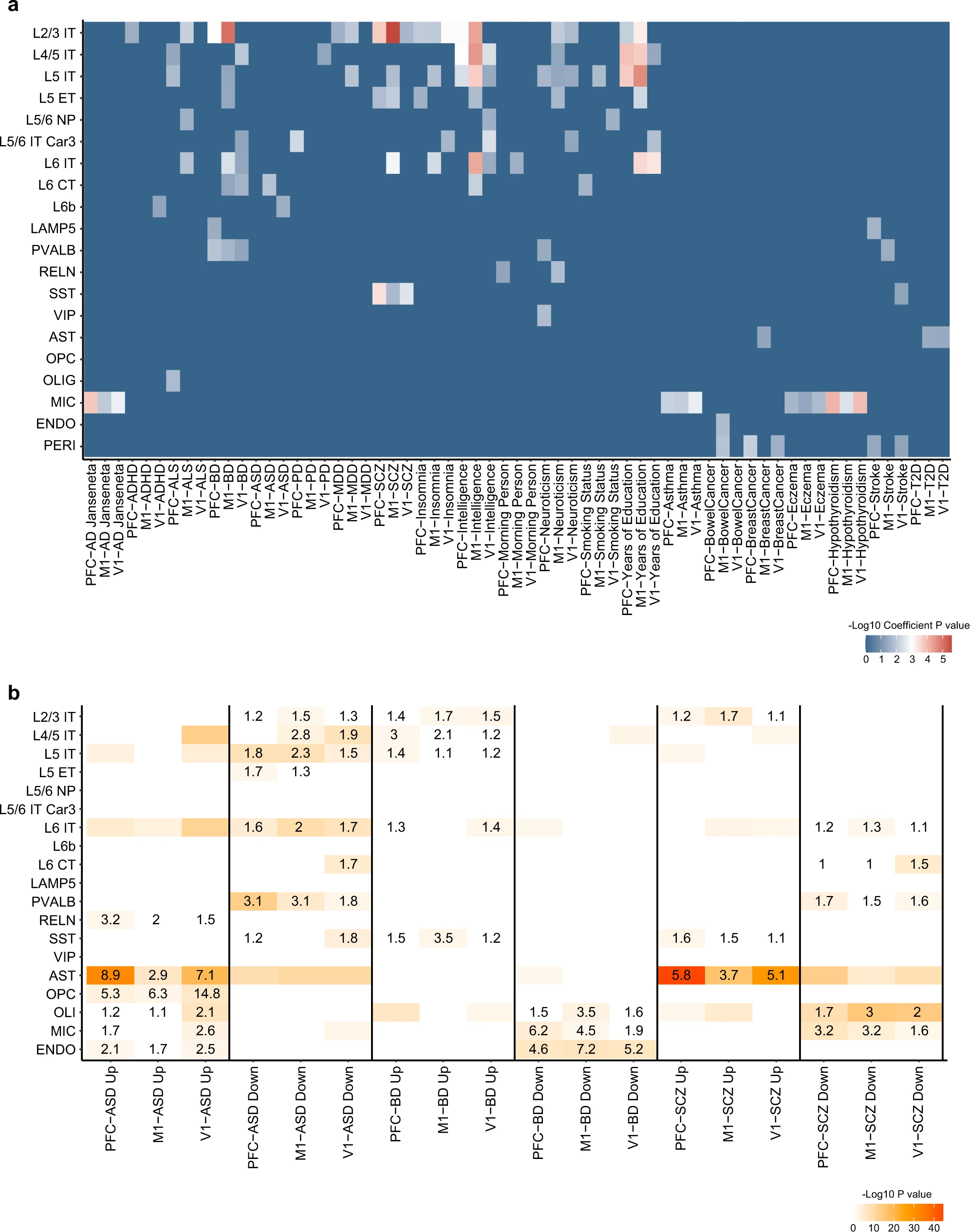
Figure 6. 遗传力和失调基因的细胞类型富集
(a) 热图显示了 PFC、M1 和 V1 的 snATAC-seq 数据中神经元和非神经元细胞类型中人类特征遗传力的富集。
(b) 神经系统疾病失调基因的细胞类型富集71在 PFC、M1 和 V1 的Stereo-seq部分。自闭症谱系障碍 (ASD)、双相情感障碍 (BD) 或 SCZ 患者与对照组相比,大脑中差异表达的基因(Up,上调基因;Down,下调基因)。
# Discussion:
在本研究中,我们生成了成年灵长类皮质的空间分辨大规模单细胞开放染色质和转录组图。为了绘制细胞类型及其在空间环境中的分子特性并研究原位皮质区域异质性,我们将 snRNA-seq 数据转移到 Stereo-seq 数据。因此,我们结合表观遗传学和转录组分析,通过Stereo-seq分析进行空间解析,协同揭示大脑皮层空间组织和细胞异质性的隐藏信息。对 OPC 和 OLI 的单细胞转录组和表观遗传分析进行综合分析,解决并行动态基因表达景观、开放染色质状态和与髓鞘形成相关的转录因子富集问题。我们使用细胞类型特异性表观遗传数据和空间解析的Stereo-seq数据来预测神经系统和神经精神疾病的风险富集。
